Protein elektroforez nedir?
Protein elektroforezi, yüklü protein moleküllerinin bir elektrik alanı ile bir çözücü aracılığıyla taşındığı standart bir laboratuvar tekniğidir. Hem proteinler hem de nükleik asitler, basit, hızlı ve hassas bir analitik araç olan elektroforez ile ayrılabilir.
Biyolojik moleküllerin çoğu, izoelektrik noktaları dışında herhangi bir pH değerinde net yük taşır ve yük yoğunluklarıyla orantılı bir oranda göç eder. Bir molekülün bir elektrik alanı boyunca hareketliliği, alan kuvveti, molekül üzerindeki net yük, molekülün boyutu ve şekli, iyonik kuvvet ve molekülün içinden geçtiği matrisin özellikleri (örn., viskozite, gözenek büyüklüğü) gibi faktörlere bağlıdır.
Poliakrilamid ve agaroz, elektroforezde yaygın olarak kullanılan iki destek matrisidir. Bu matrisler gözenekli ortam görevi görür ve moleküler elek gibi davranır. Agaroz büyük bir gözenek boyutuna sahiptir ve nükleik asitleri ve büyük protein komplekslerini ayırmak için uygundur. Poliakrilamid daha küçük bir gözenek boyutuna sahiptir ve proteinlerin çoğunu ve daha küçük nükleik asitleri ayırmak için idealdir.
Poliakrilamid jeller nelerdir?
Poliakrilamid, proteinleri boyutlarına göre ayırmak için elektroforetik jeller hazırlamak için tercih edilen malzemedir. Poliakrilamid jeller, polimerleştirici madde, amonyum persülfat (APS) eklendiğinde çapraz bağlı bir polimer ağı oluşturmak için akrilamid ile bisakrilamid karıştırılarak hazırlanır. TEMED (N,N,N’,N'-tetrametilendiamin), APS tarafından serbest radikallerin üretimini teşvik ederek polimerizasyon reaksiyonunu katalize eder. Bu aşamada poliakrilamid olur.

SDS-PAGE (denatüre edici) ile Native-PAGE
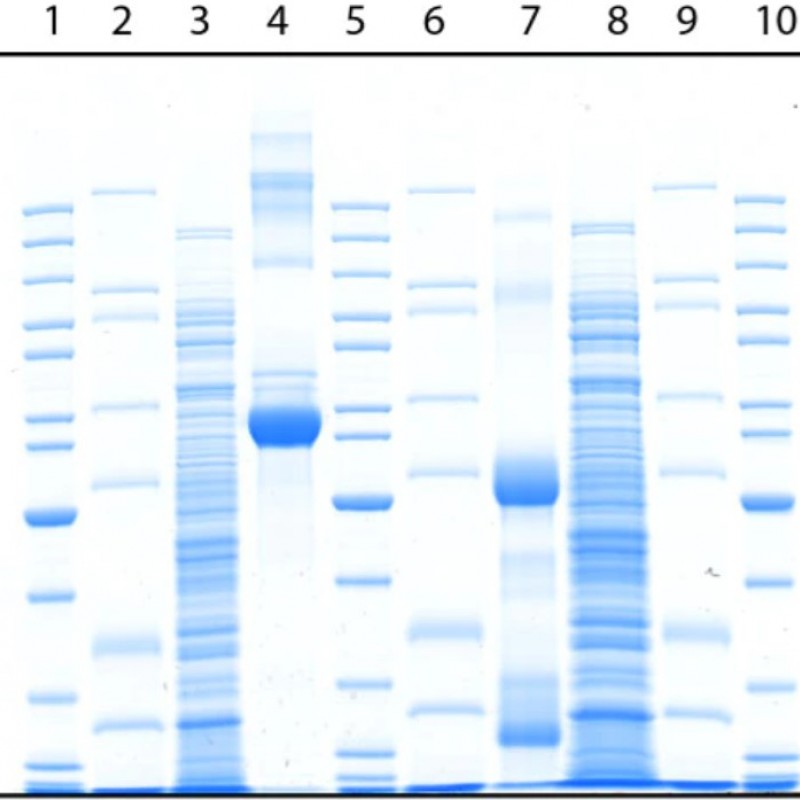
SDS-PAGE
SDS-PAGE'de jel, anyonik bir deterjan olan sodyum dodesil sülfat (SDS) içeren bir tampon içine dökülür. SDS, polipeptit omurgasını sararak proteinleri denatüre eder. Protein numunesinin fazla SDS ve tiyol reaktifi varlığında 70-100°C arasında ısıtılmasıyla disülfid bağları parçalanır ve protein tamamen alt birimlerine ayrılır. Bu koşullar altında çoğu polipeptit, SDS'yi sabit bir ağırlık oranında (1.4 g SDS: 1 g polipeptit) bağlar. Polipeptidin içsel yükleri, bağlı deterjan tarafından sağlanan negatif yüklere kıyasla önemsizdir, böylece SDS-polipeptid kompleksleri esasen aynı negatif yüke ve şekle sahiptir. Sonuç olarak, proteinler, kompozisyon farklılıklarından çok az etki ile kesinlikle polipeptit boyutuna göre jelden geçer. Bu yöntemin basitliği ve hızı ve ayrıca yalnızca mikrogram miktarlarda protein gerekliliği gerçeği, SDS-PAGE'i bir polipeptit numunesindeki moleküler kütlenin belirlenmesi için en yaygın kullanılan yöntem haline getirmiştir. Hemen hemen her kaynaktan gelen proteinler, SDS tarafından kolaylıkla çözündürülür, bu nedenle yöntem genel olarak uygulanabilirdir.
Bilinen kütleye sahip bir dizi protein, aynı jel içinde numunelerin yanında çalıştırıldığında, numune proteinlerinin kütlesinin belirlenebileceği bir referans sağlarlar. Bu referans protein setleri, kütle işaretleri veya moleküler ağırlık işaretleri (MW işaretleri), protein merdivenleri veya boyut standartları olarak adlandırılır ve bunlar ticari olarak çeşitli şekillerde mevcuttur.
Native-PAGE
Native-PAGE'de proteinler, doğal yapılarının net yüküne, boyutuna ve şekline göre ayrılır. Elektroforetik göç, çoğu proteinin alkali çalışan tamponlarda net bir negatif yük taşıması nedeniyle oluşur. Negatif yük yoğunluğu ne kadar yüksek olursa (molekül kütlesi başına daha fazla yük), bir protein o kadar hızlı göç eder. Aynı zamanda jel matrisinin sürtünme kuvveti, proteinlerin hareketlerini boyutlarına ve üç boyutlu şekillerine göre düzenleyerek bir eleme etkisi yaratır. Küçük proteinler yalnızca küçük bir sürtünme kuvvetiyle karşı karşıya kalırken, daha büyük proteinler daha büyük bir sürtünme kuvvetiyle karşı karşıyadır. Böylece doğal-PAGE, proteinleri hem yüklerine hem de kütlelerine göre ayırır.
Native-PAGE'de hiçbir denaturant kullanılmadığından, bir multimerik protein içindeki alt birim etkileşimleri genellikle korunur ve kuaterner yapı hakkında bilgi elde edilebilir. Ek olarak, bazı proteinler, Native-PAGE ile ayırmanın ardından enzimatik aktivitelerini (işlevlerini) korurlar. Dolayısıyla bu teknik, saflaştırılmış, aktif proteinlerin hazırlanması için kullanılabilir.

Elektroforezi takiben, proteinler, pasif difüzyon veya elektro-elüsyon yoluyla doğal bir jelden geri kazanılabilir. Elektroforez sırasında proteinlerin bütünlüğünü korumak için aparatı serin tutmak ve denatürasyon ve proteolizi en aza indirmek önemlidir. Doğal-PAGE'de aşırı pH değerlerinden genellikle kaçınılmalıdır, çünkü bunlar ilgili proteinlerde denatürasyon veya agregasyon gibi geri dönüşü olmayan hasara yol açabilir.
Protein Merdivenleri ve Standartları
Bir jeldeki proteinlerin moleküler kütlelerini (boyutlarını) değerlendirmek için, moleküler kütleleri bilinen birkaç proteini içeren hazırlanmış bir karışım, jelin bir veya daha fazla şeridinde test numunesi ile birlikte çalıştırılır. Bu tür bilinen protein kümelerine, protein moleküler ağırlık (veya kütle) belirteçleri veya protein merdivenleri denir. Her işaretleyici protein tarafından taşınan mesafelerden standart bir eğri oluşturulabilir. Bilinmeyen protein tarafından taşınan mesafe daha sonra çizilir ve moleküler ağırlık standart eğriden tahmin edilir.

Farklı algılama modları için etiketlenmemiş veya önceden boyanmış birkaç çeşit kullanıma hazır protein moleküler ağırlık (MW) belirteci mevcuttur. Bunlar önceden indirgenmiştir ve bu nedenle, yerel PAGE yerine öncelikle SDS-PAGE için uygundur. MW belirteçleri, flüoresan etiket gibi özel etiketler ve diğer yöntemlerle de saptanabilir hale getirilebilir.